求臻医学“肺癌基因检测试剂盒分析软件”获批NMPA Ⅱ类医疗器械注册证
近日,求臻医学自主研发的“肺癌基因检测试剂盒分析软件”成功荣获国家药品监督管理局(NMPA)颁发的Ⅱ类医疗器械注册证(注册证编号:京械注准20242210473)。
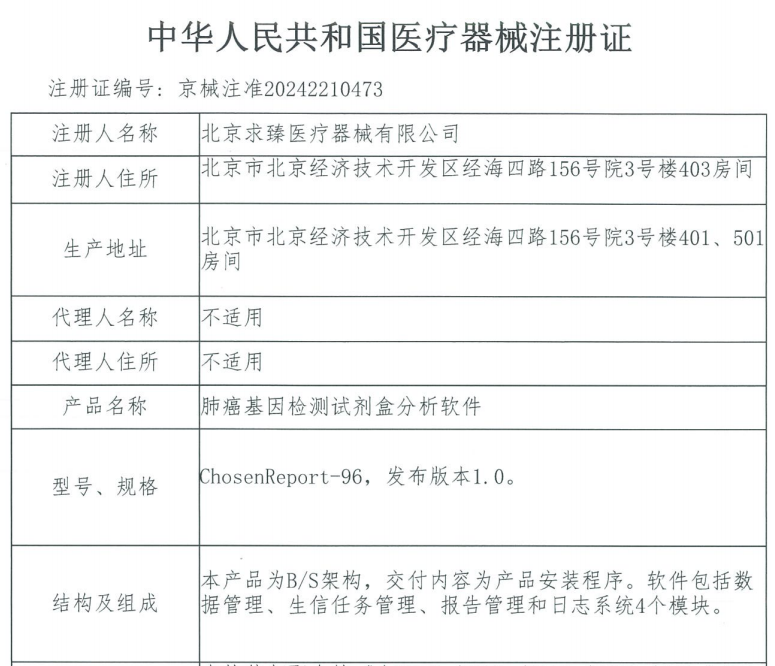
医疗器械注册证是确保医疗器械产品合法性的关键凭证,本次获证意味着求臻医学的这款软件已经通过了严格的监管审批流程,能够为医疗机构提供更为强有力的技术支持和质量保障,进而为肺癌患者提供更加精准、高效的诊疗方案。
针对非小细胞肺癌患者,该分析软件展现出强大的独立分析能力。它通过对测序仪上获得的特定基因DNA片段序列进行数据分析,能够报告EGFR基因(19Del、L858R、T790M、G719S、S768I、L861Q、D770_N771insG突变),KRAS基因(G12D、G12A、G12V、G12S、G12C、G13D突变),HER2基因(A775_G776insYVMA突变),BRAF基因(V600E突变),ALK基因(融合)与ROS1基因(融合)多个基因的信息分析结果。
值得一提的是,该软件在设计上融入了三大核心优势,为分析解读及数据安全保驾护航。
1.无缝整合测序与分析
与Nextseq™ 550Dx测序仪的完美协同,确保从样本测序到数据分析的无缝对接。
2.全面单样本检测能力
支持对SNV、InDel、Fusion三种变异类型的单样本(Tumor Only)精准分析,提升检测效率与准确性。
3.安全高效的数据处理环境
依托B/S架构,提供直观易用的界面;独有的生信分析容器,确保数据安全、资源安全,避免环境冲突,为数据安全护航。
今年年初,求臻医学人EGFR/KRAS/BRAF/HER2/ALK/ROS1基因突变检测试剂盒(可逆末端终止测序法)(国械注准20243400353)已拿到NMPA三类医疗器械注册证,搭配本次获证软件、Illumina Nextseq™ 550Dx测序仪(国械注进20203220453),共同构建起个性化诊疗的一站式解决方案,推动肿瘤精准诊疗在临床的广泛应用与落地。

至此,求臻医学已全面完成了从核酸提取/建库/测序试剂盒到数据分析软件的全流程注册备案,实现了肿瘤高通量测序的闭环应用,能够为肿瘤临床用户提供高质合规的全方位解决方案。求臻医学将秉承“探索科技创新 致力医学求臻”的企业使命,在肿瘤精准诊疗领域持续深耕细作,不断开拓创新,为推动我国医疗健康事业的进步与发展贡献力量。
延伸 · 阅读
- 2024-11-14车展预热启动,全新一代林肯领航员即将登场,期待值爆表
- 2024-11-12内外升级更实用,入手门槛再降低,2025款锐界L 22.68万起
- 2024-11-12别再只是刷卡了!来看看你的光大星光等级能享受几折优惠 ~
- 2024-11-071
- 2024-11-06分支机构 | 北京整合医学学会心理行为医学专委会2024中西医结合睡眠心理疾病研讨会
- 2024-11-06守中医之正,创中医之新薛医堂和誉盛堂中医药服务简述














